Beri (Be) hóa trị mấy? Tính chất và ứng dụng trong cuộc sống

Tìm hiểu Be hóa trị mấy và tính chất của nguyên tố hóa học này. Nội dung thông tin đã được biên soạn kỹ nhằm đảm bảo tính chính xác đến với người đọc. Bạn có thể tham khảo nội dung bài viết để hiểu hơn về môn học và chuyên ngành này.
Be hóa trị mấy?
Be có hóa trị II.
Bạn đang xem: Beri (Be) hóa trị mấy? Tính chất và ứng dụng trong cuộc sống
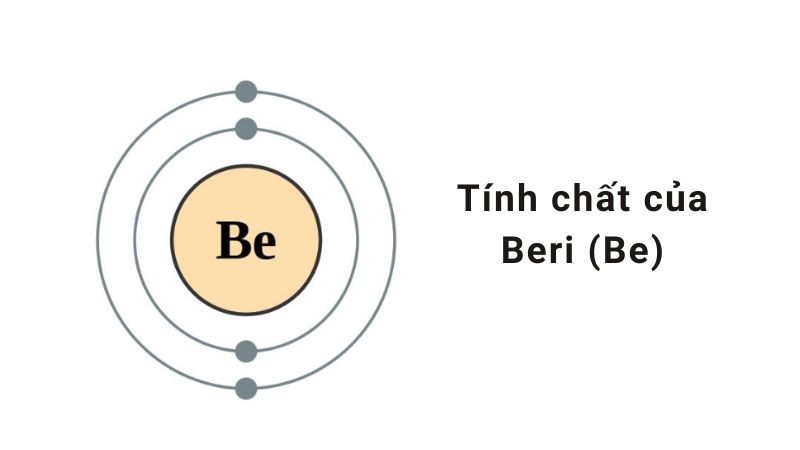
Be là ký hiệu hóa học của nguyên tố Beri thuộc ô thứ 4 trong bảng tuần hoàn. Dựa vào cấu hình electron nguyên tử, ta có thể biết được Beri hóa trị mấy. Cấu hình e của Be là 1s22s2 hoặc được viết gọn là [He]2s2. Điều này cho thấy nguyên tử Be có 4 electron và có xu hướng nhường 2 electron để đạt cấu hình bền. Vì vậy, Beri có hóa trị II (dựa vào cấu hình e).
Các hợp chất bao trọng của Be gồm có:
- Beri oxit (BeO)
- Beri cacbonat (BeCO3)
- Beri clorua (BeCl2)
- Beri florua (BeF2)
- Beri nitrat (Be(NO3)2)
Một số thông tin về Beri trong bảng tuần hoàn hóa học:
- Beri là kim loại
- Số hiệu nguyên tử: 4
- Khối lượng nguyên tử: 9
- Nhóm: IIA, chu kì: 2
- Các đồng vị: 7Be, 8Be, 9Be, 10Be. Trong đó, 9Be là ổn định nhất.
- Độ âm điện: 1,57

Tính chất vật lý của Beri
Be là kim loại có màu xám nhạt, tuy nhẹ nhưng khá cứng và giòn ở nhiệt độ thường. Khi đun nóng, Beri sẽ trở nên dẻo hơn. Ngoài ra, nguyên tử này sẽ có ánh màu tím khi ở ngoài không khí.
Beri có khối lượng riêng là 1,85 g/cm3. Kim loại này sẽ bị nóng chảy ở nhiệt độ 12870C và sôi ở nhiệt độ 25070C.
Xem thêm : Al hóa trị mấy? Tìm hiểu về tính chất và ứng dụng của Nhôm
Để nhận biết Be, ta có thể thực hiện phương pháp đốt hợp chất của Be. Lúc này Be sẽ cho ngọn lửa màu trắng.
Tính chất hóa học của Beri
Beri là chất khử mạnh, yếu hơn Li và Mg. Trong một hợp chất, Be tồn tại dưới dạng ion Be2+: Be → Be2+ + 2e. Do đó, tính chất hóa học của Be có tính lưỡng tính nên có thể tác dụng với nhiều chất khác. Cụ thể như sau:
Tác dụng với axit
Beri khi tác dụng với axit sẽ sinh ra muối kim loại. Phương trình phản ứng hóa học xảy ra như sau:
- Be + H2SO4 → BeSO4 + H2
- Be + 2HCl → BeCl2 + H2
- 3Be + 8HNO3 (loãng,nóng) → 3Be(NO3)2 + 2NO + 4H2O
Tác dụng với phi kim
Trong không khí, Be oxi hóa chậm tạo thành màng oxit mỏng để bảo vệ kim loại. Be sẽ cháy khi đốt nóng trong oxi (O2). Phản ứng hóa học giữa Be và Oxi được viết như sau:
- 2 Be + O2 → 2BeO
Tác dụng với dung dịch kiềm
Beri có thể tác dụng với dung dịch bazơ mạnh. Phương trình phản ứng bao gồm:
- Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
- Be + 2NaOHn/c → Na2BeO2 + H2
Tác dụng với nước (H2O)
Be không thể tác dụng với nước trong điều kiện nhiệt độ thường, phản ứng hóa học sẽ không xảy ra.
Cách điều chế Beri
Beri có thể được điều chế chủ yếu từ các hợp chất thông qua các phản ứng hóa học bằng phương pháp nhiệt luyện. Phương trình phản ứng điều chế Be xảy ra như sau:
- BeF2 + Mg → MgF2 + Be
Xem thêm : C hóa trị mấy? Tính chất vật lý, hóa học và cách điều chế Carbon
Các phản ứng điều chế Be được áp dụng trong phòng thí nghiệm và công nghiệp. Mục đích của phản ứng là để sản xuất Beri nhằm phục vụ cho sản xuất hợp kim, ứng dụng trong ngành công nghệ và quốc phòng.

Ứng dụng của Beri trong cuộc sống
Beri là một kim loại quan trọng có thể ứng dụng trong các ngành công nghiệp khác nhau. Các ứng dụng của Be bao gồm:
Công nghiệp sản xuất hợp kim
Beri được sử dụng tương tự như một chất tạo hợp kim. Beri đồng có tính dẫn điện và dẫn nhiệt tốt, độ bền và độ cứng cao, và không gây ô nhiễm. Do đó, hợp kim này được lựa chọn để ứng dụng nhiều trong ngành công nghiệp hiện nay.
Ngoài ra, Be còn được ứng dụng trong công nghiệp quốc phòng và hàng không. Be sử dụng để làm vật liệu có kết cấu nhẹ trong máy bay, tên lửa, tàu vũ trụ,…
Công nghệ in thạch bản tia X
Be được ứng dụng trong việc tái tạo các mạch tích hợp cực kỳ nhỏ trong kỹ thuật khắc tia X. Điều này là nhờ vào khả năng hấp thụ tia X và nhiệt độ cao của Be.
Lò phản ứng hạt nhân
Trong công nghiệp sản xuất điện hạt nhân, Be được sử dụng như chất phản xạ nơtron và bộ điều chỉnh trong các lò phản ứng hạt nhân.
Sản xuất các thiết bị nhẹ và có độ ổn định cao
Beri được sử dụng trong sản xuất con quay hồi chuyển, thiết bị máy vi tính, lò xo đồng hồ và các thiết bị có yêu cầu trọng lượng nhẹ và ổn định.
Kết luận
Biết được Be hóa trị mấy sẽ giúp bạn viết phương trình phản ứng dễ dàng hơn. Nắm vững được kiến thức về các nguyên tố hóa học là cách để bạn học tốt bộ môn này.
Nguồn: https://thoitiet4m.online
Danh mục: Hóa trị nguyên tử