NO3 hóa trị mấy? Nhận biết và cách điều chế thường dùng

NO3 hóa trị mấy vẫn là vấn đề nhận được nhiều sự quan tâm. Ngoài ra, nghiên cứu thêm đặc điểm cơ bản và những nơi xuất hiện chất này nhiều nhất cũng giúp bạn cải thiện kiến thức hóa học đáng kể.
NO3 là gì?
NO3 là chất hóa học có 1 nguyên tử Nitơ kết hợp với 3 nguyên tử Oxi bao quanh trên mặt phẳng tam giác. Đây được gọi là bazơ liên hợp của axit nitric. Một số tên gọi khác được dùng gồm: Nitrate, nitrat, có khối lượng phân tử là 62.
Bạn đang xem: NO3 hóa trị mấy? Nhận biết và cách điều chế thường dùng
Dưới nước có tác động vi khuẩn từ NH3 phân hủy tạo NO2, NO3 là sản phẩm cuối cùng của phản ứng.
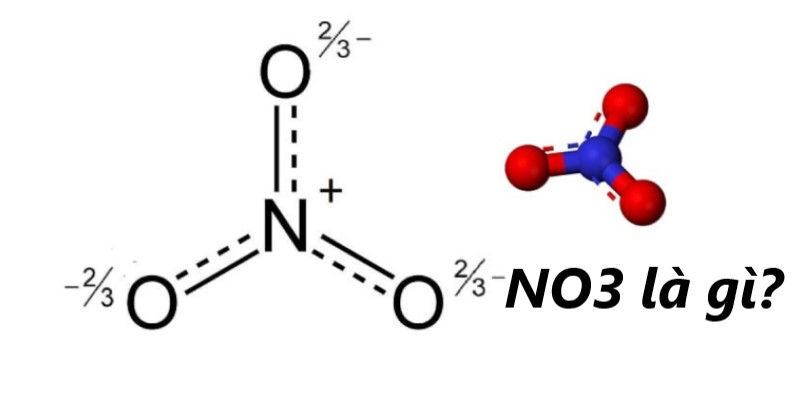
NO3 hóa trị mấy?
NO3 có hóa trị là -1, N trong ion NO3- là +5.
Số oxi hóa của N là a, có thể thấy a + 3.(-2) = -1 => a = +5.
Giải thích NO3 hóa trị bao nhiêu, bạn quan sát NO3 là ion nitrat. Chất này có cấu tạo cụ thể gồm:
- 1 nguyên tử Nitơ, N mang hóa trị -3.
- 3 nguyên tử Oxi (O), O có hóa trị là -2.
Mặc dù vậy, có đến 3 nguyên tử oxi cùng hóa trị -2. N chỉ có 1 nguyên tử -3. Như vậy, bạn có ion Nitrat với tổng hóa trị:
3 x (-2) + (-3) = (-9)
Đối với ion nitrat, tạo điện tử (-1) phải giảm từ hóa trị -9 xuống còn -1.
Tính chất vật lý của NO3 là gì?
Nitrate có dạng muối, nước hoặc khí, căn cứ theo từng điều kiện cụ thể:
- Kali nitrat (KNO3): Muối rắn.
- Nitrat amon NH4NO3): Hạt rắn hoặc nước.
Xem thêm : CO2 hóa trị mấy? Ứng dụng của carbon dioxide
Các muối này có điểm nóng chảy/sôi khác nhau, tùy theo ion kết hợp, giả sử nước amon nitrat có điểm nóng chảy 169.6 độ C, điểm sôi 210 độ C. NO3 còn hòa tan trong nước tạo ra dung dịch ion nitrat trong nước, có thể hòa tan các chất khác.
Ngoài ra, nitrate dùng để ổn định nhiệt độ và áp suất phòng thông thường. Nitrat sẽ phân hủy dưới tác động ánh sáng mặt trời ở nhiệt độ cao.
Tính chất hóa học của NO3
NO3 có một số tính chất hóa học đặc trưng để phân biệt với những chất khác. Nitrat có khả năng tham gia phản ứng nhiệt phân, phản ứng với axit và tan trong dung dịch (dd) kiềm.
| Tính chất | Chi tiết |
| Tan trong dd kiềm | NO3 oxi hóa được kim loại lưỡng tính hay tan trong dung dịch kiềm.
8Al + 3NO3 + 5OH- + 2H20 -> 8AlO2 + 3NH3. NH3 tạo thành chất khí bay hơi. |
| Phản ứng nhiệt phân | Nhiệt phân muối nitrat hoạt động trước Mg (Nhiệt độ cao): Nitrat -> Nitrit + O2.
Muối nitrat hoạt động sau Đồng kết thúc tạo kim loại: Nitrat -> Kim loại + NO2 + O2. Muối nitrat của kim loại (Từ Mg đến Cu) thu được oxit kim loại NO2, O2: Nitrat -> Oxit kim loại + NO2 + O2. |
| Phản ứng với axit | 3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO↑ + 2H2O
3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO↑ + 4H2O |
NO3 gây hại gì?
NO3 có thể gây ra nhiều ảnh hưởng đến con người, sinh vật và cả môi trường:
- Con người: Hàm lượng Nitrat cao hơn 10 mg/l gây da xanh ở trẻ. Cơ thể thừa NO3 làm giảm chức năng vận chuyển oxy, thiếu oxy lên não, có thể nguy hiểm đến tính mạng, nặng nhất sẽ tử vong.
- Sinh vật: Làm giảm sự sinh sản trong nuôi trồng thủy sản, gây ảnh hưởng trực tiếp đến cây trồng và vật nuôi. Một số ví dụ điển hình cho sự ảnh hưởng của nitrate gồm: Tôm rụt câu, cá bỏ ăn, nhợt nhạt và có thể bị chết.
- Môi trường: Quá nhiều NO3 trong không khí cản trở quá trình hấp thu của cây, chất này ngấm vào lòng đất gây ảnh hưởng đến nguồn nước.
NO3 có ở đâu?
NO3 phát sinh từ nhiều nguồn khác nhau, nổi bật nhất gồm:
- Tạo từ Nitơ tự nhiên trong lòng trái đất, chiếm tỷ lệ cao trong khí quyển. Do đó, quá trình sinh Nitrat diễn ra thường xuyên.
- NO3 cũng thường xuất hiện trong đồ ăn, thức uống nhưng không quá nhiều. Nếu quá liều lượng có thể dẫn đến ảnh hưởng lớn đến sức khỏe con người.
- Cây cối cũng có hấp thụ Nitrat trong đất, dẫn đến lá, quả cũng chưa một lượng khá nhỏ, không đáng kể.
- Chất này cũng xuất hiện trong quá trình phân hủy xác động vật.
- Tạo ra quá trình vi sinh vật chuyển hóa thành phân bón.
Cách điều chế HNO3
NO3 xuất hiện trong tự nhiên từ những cơn mưa lớn có sét. Đây là nguyên nhân chính cho sự xuất hiện của những cơn mưa axit. Ngoài ra, còn có phương pháp điều chế nitrate trong phòng thí nghiệm hoặc công nghiệp.
Phương pháp điều chế nitrat trong phòng thí nghiệm
Cho muối nitrat tinh thể tác dụng với axit sunfuric đặc. Cho hỗn hợp chưng cất với mức nhiệt độ sôi axit nitric đạt 83 độ C đến khi còn lại chất kết tinh màu trắng.
Phương trình 1: H2SO4 đặc + NaNO3 (tinh thể) → HNO3 + NaHSO4

Xem thêm : CO hóa trị mấy? Tìm hiểu về tính chất và cách sản xuất
Axit nitric có thể tạo ra bằng cách phân hủy nhiệt của đồng (II) nitrat. Phản ứng này sẽ tạo ra nitơ dioxide và oxy, sau đó truyền qua nước cho ra axit nitric:
Phương trình 2: 2Cu(NO3) 2 → 2 CuO + 4 NO2 + O2
Phương trình 3: 4 NO 2 + O2 →HNO2 +HNO3
Cách điều chế HNO3 thường gặp trong công nghiệp
NO3 loãng có thể cô đặc được 68% axit với hỗn hợp azeotropic 32% nước. Muốn thu axit nồng độ cao hơn cần chưng cất axit sunfuric, đây là chất khử sẽ hấp thu lại nước.
Phương trình hóa học:
4NH3 + 5O2 → 4NO + 6H2O (Pt, 850 độ C)
2NO + O2 → NO2
4NO2 + O2 + 2H2O → 4HNO3

Axit công nghiệp thường có nồng độ 52 đến 68%. Sản xuất NO3 được thực hiện thông qua công nghệ Ostwald do Wilhelm Ostwald.
Lời kết
Xác định NO3 hóa trị mấy giúp cho bạn hiểu rõ hơn đặc điểm, tính chất vật lý và hóa học. Chất này có thể điều chế trong phòng thí nghiệm hoặc công nghiệp, đặc biệt cũng xuất hiện nhiều trong tự nhiên.
Nguồn: https://thoitiet4m.online
Danh mục: Hóa trị phân tử