SO3 hóa trị mấy? Công thức cấu tạo, tính chất hóa học nổi bật
Kiến thức SO3 hóa trị mấy là cơ bản, có ảnh hưởng đến quá trình xác định phản ứng hóa học. Sulfur trioxide có ảnh hưởng đến nhiều lĩnh vực, từ nghiên cứu khoa học, ứng dụng nhiều trong công nghiệp.
SO3 hóa trị mấy?
SO3 hóa trị 1, S trong SO3 có hóa trị 6.
Bạn đang xem: SO3 hóa trị mấy? Công thức cấu tạo, tính chất hóa học nổi bật
Gọi hóa trị của SO3 trong HSO3 là a, H có hóa trị 1. Theo quy tắc hóa trị có: 1×1 = 1xa => a = 1.
Gọi hóa trị của S là x, hóa trị O là 2. Theo công thứ: 1.x = 2.3 => x = 6.

SO3 là gì?
SO3 thuộc loại oxit axit quan trọng, có dạng chất lỏng, không màu, hòa tan vô hạn trong nước hoặc axit sunfuric. Lưu huỳnh trioxit không gây ra tình trạng ăn mòn mòn kim loại. Trong trạng thái chất khí,SO3 gây ô nhiễm nghiêm trọng, là yếu tố gây ra tình trạng mưa axit. Oxit axit này được sản xuất quy mô lớn, có thể ứng dụng sản xuất axit sunfuric.
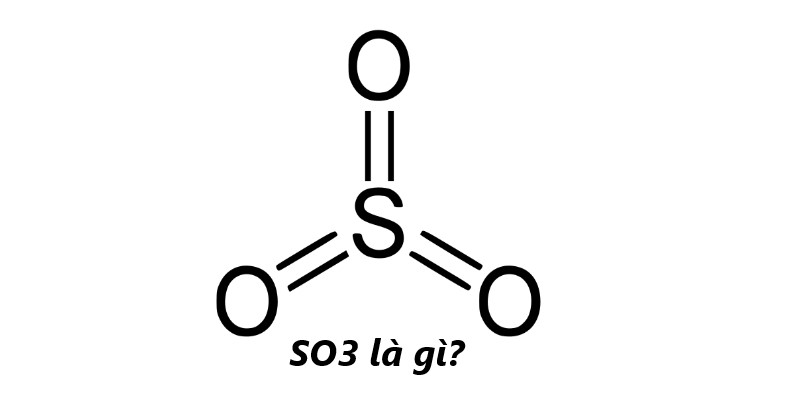
Đặc điểm đặc trưng của SO3
SO3 có lưu hùynh thuộc nhóm phi kim, với trạng thái oxi hóa +6. Điều này đồng nghĩa với tính axit mạnh của oxit, do đó gọi là oxit axit. Tính chất đặc trưng của lưu huỳnh trioxit là phản ứng mạnh với nước để tạo ra axit sunfuric (H2SO40): H2SO4 + H2O -> H2SO4.
Xem thêm : S trong SO2 hóa trị mấy? Cách điều chế và những nơi xuất hiện chất SO2
SO3 tác dụng với dung dịch bazơ tạo thành 2 muối là sunfat và hidro sunfat. Phương trình hoá học được thể hiện:
- SO3 + KOH -> KHSO4
- SO3 + 2KOH -> K2SO4 + H2O
Nếu cho SO3 tác dụng với NaOH sẽ tạo được 2 muối: Muối axit hidrosunfat và muối trung hoà sunfat.
Nhận biết SO3 như thế nào?
Muốn nhận biết được SO3 khá đơn giản, bạn chỉ cần cho dung dịch Bari clorua BaCl2. Phản ứng này cho ra hiện tượng kết tủa.
SO3 + H2O + BaCl2 -> BaSO4 + 3HCl.
Ứng dụng SO3 trong lĩnh vực nào?
SO3 được ứng dụng trong nhiều lĩnh vực đời sống. Cụ thể, ion này được thực hiện để phục vụ nhiều nhu cầu của con người gồm:
- Làm trung gian sản xuất axit sunfuric trong công nghiệp.
- Hỗ trợ cho quá trình tẩy trắng loại bỏ Hydro peroxide sót lại. Đây cũng được xem là tác nhân hỗ trợ tách bột giấy khỏi lignin.
- Là sương mù axit vô cơ mạnh có chứa axit sunfuric trong công nghiệp hoặc sản xuất sản phẩm thương mại liên quan.
- Thuốc thử thiết yếu trong phản ứng sulfonation.
- Sản xuất tế bào quang điện và những thiết bị dùng năng lượng mặt trời.
Hướng dẫn xử lý SO3
SO3 có thể gây ảnh hưởng không nhỏ đến sức khỏe con người. Muốn xử lý khí thải chứa lưu huỳnh trioxit cần dựa vào tính chất hoá học. Cụ thể, bạn dùng SO2 và SO3 tiếp xúc bazơ (KOH, NaOH, Ca(OH)2,…) nhằm tạo gốc muối axit.
Cách điều chế
Xem thêm : OH hóa trị mấy? Các ứng dụng trong cuộc sống
Muốn điều chế SO3, có thể thực hiện oxi hoá lưu huỳnh dioxide ở nhiệt độ cao. Oxi có thêm sự xuất hiện của chất xúc tác Vanadi (V) oxit sẽ tạo được phản ứng hoá học:
2SO2 + O2 -> SO3 (Trong phương trình, chất xúc tác là V2O5 được thực hiện ở nhiệt độ khoảng 450-500 độ C).
Ngoài ra, còn một cách điều chế khác có thể ứng dụng ngay. Cụ thể, bạn cho SO2 phản ứng với O2, nhiệt độ thấp hơn nhưng có chất xúc tác NO2.
2SO2 + O2 -> 2SO3 + NO.
O2 được sinh ra tiếp tục phản ứng với NO và tạo thành NO2. Quá trình phản ứng được lặp lại nhiều lần liên tục tạo được SO3.
Riêng trong phòng thí nghiệm, có thể chưng cất axit sunfuric tạo phản ứng bốc khói trong dụng cụ toàn thuỷ tinh.
Lời kết
Xác định SO3 hoá trị mấy và những đặc điểm vật lý, hoá học giúp bạn nắm rõ kiến thức của chất này. Những yếu tố này cũng ảnh hưởng đến cách điều chế và ứng dụng trong cuộc sống. Lưu huỳnh trioxit cần được kiểm soát chặt vì có thể gây ảnh hưởng trực tiếp đến sức khoẻ con người.
Nguồn: https://thoitiet4m.online
Danh mục: Hóa trị phân tử